- 《答聶文蔚》 [2017/04]
- 奧巴馬致女友:我每天都和男人做愛 [2023/11]
- 愛國者的喜訊,干吃福利的綠卡族回國希望大增 [2017/01]
- 周五落軌的真的是個華女 [2017/03]
- 現場! 全副武裝的警察突入燕郊 [2017/12]
- 法拉盛的「雞街」剛剛又鬧出人命 [2017/11]
- 大部分人品太差了--- 中國公園裡的「黃昏戀」 [2019/12]
- 亞裔男孩再讓美國瘋狂 [2018/09]
- 年三十工作/小媳婦好嗎 /土撥鼠真屌/美華素質高? [2019/02]
- 看這些入籍美加的中國人在這裡的醜態百出下場可期 [2019/11]
- 黑暗時代的明燈 [2017/01]
- 文革宣傳畫名作選之 「群醜圖」 都畫了誰? [2024/01]
- 當今的美國是不是還從根本上支持中國的民主運動? [2017/10]
- 香港的抗爭再次告訴世人 [2019/06]
- 中國女歡呼日本地震 歐洲老公驚呆上網反思 [2024/01]
- 加入外國籍,你還是不是中國人?談多數華人的愚昧和少數華人的覺醒 [2018/02]
- 周末逛法拉盛,還是坐地鐵? [2017/10]
- 春蠶到死絲方斷, 丹心未酬血已干 [2017/03]
特別通告:
根據達賴喇嘛尊者醫療團隊的建議,尊者因感冒需要休息。我們將10月2/3日兩天的法會,祈請甘丹赤巴仁波切開示主持。特此公告。
10月3日台灣佛教信眾的共同祈請,將傳授佛法課程
內容: 菩提道次第攝頌、修心七義
印度時間:大約上午8點開始
台灣/北京時間:大約上午十點半開始
地點:北印 達蘭薩拉 大乘法苑
主辦單位:台灣國際藏傳法脈總會
菩提道次第攝頌法本:http://e-dalailama.com/sutra/brief_st...
修心七義法本:http://e-dalailama.com/sutra/7.pdf
(直播中)
>> More Videos
2023年10月2日菩提道次第攝頌(到「以菩提心為心要」)
2023年10月2日應台灣佛教信眾的共同祈請,甘丹赤巴仁波切傳授佛法課程
內容: 菩提道次第攝頌
至戊一、發菩提心
大乘道命為發心,是菩薩行根本依,
能轉資糧如金汁,攝納眾善為福藏,
菩薩如是善了知,「以菩提心為心要」,
至尊恩師如是修,欲解脫者如是行。
地點:北印 達蘭薩拉 大乘法苑
>> More Videos
新聞發布 2023-10-02
諾貝爾大會羅林斯卡學院今天決定共同 授予2023 年諾貝爾生理學或醫學獎卡塔琳·卡里科和德魯·韋斯曼
表彰他們在核苷鹼基修飾方面的發現,這些發現使得開發針對 COVID-19 的有效 mRNA 疫苗成為可能
兩位諾貝爾獎獲得者的發現對於在 2020 年初開始的新冠病毒大流行期間開發有效的針對 COVID-19 的 mRNA 疫苗至關重要。他們的突破性發現從根本上改變了我們對 mRNA 如何與免疫系統相互作用的理解,獲獎者做出了貢獻 在現代人類健康面臨的最大威脅之一期間,疫苗的開發速度前所未有。
疫情爆發前的疫苗
疫苗接種會刺激針對特定病原體的免疫反應的形成。 這使得身體在以後接觸疾病時能夠搶佔先機。 基於滅活或弱化病毒的疫苗早已問世,例如針對脊髓灰質炎、麻疹和黃熱病的疫苗。 1951年,馬克斯·泰勒因開發黃熱病疫苗而獲得諾貝爾生理學或醫學獎。
由於近幾十年來分子生物學的進步,基於單個病毒成分而不是整個病毒的疫苗已經被開發出來。 部分病毒遺傳密碼通常編碼病毒表面的蛋白質,用於製造刺激病毒阻斷抗體形成的蛋白質。 例如針對乙型肝炎病毒和人乳頭瘤病毒的疫苗。 或者,部分病毒遺傳密碼可以轉移到無害的攜帶病毒中,即「載體」。 該方法用於抗埃博拉病毒的疫苗。 當注射載體疫苗時,選定的病毒蛋白會在我們的細胞中產生,刺激針對目標病毒的免疫反應。
生產基於病毒、蛋白質和載體的疫苗需要大規模細胞培養。 這種資源密集型過程限制了快速生產疫苗以應對疫情和大流行的可能性。 因此,研究人員長期以來一直試圖開發獨立於細胞培養的疫苗技術,但這被證明具有挑戰性。
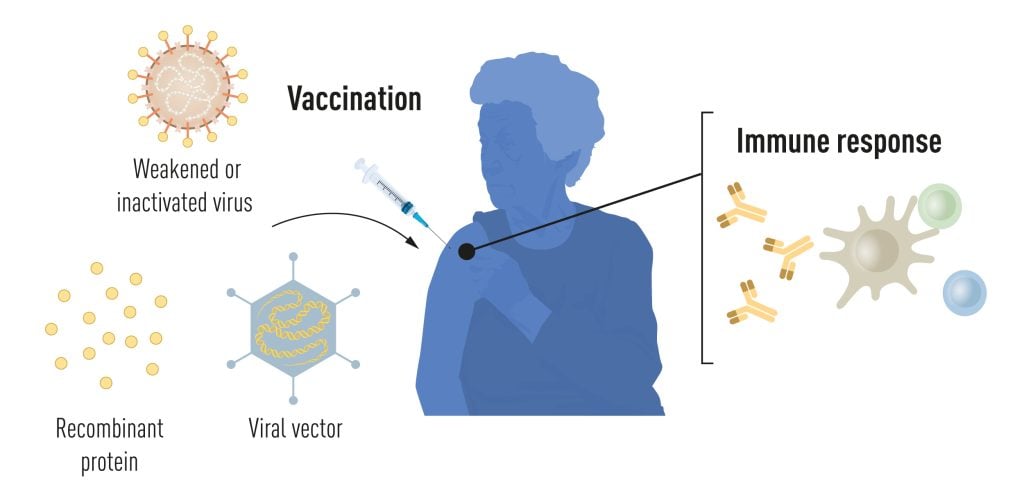
圖 1. COVID-19 大流行之前的疫苗生產方法。 © 諾貝爾生理學或醫學委員會。 馬蒂亞斯·卡倫
mRNA 疫苗:一個有前途的想法
在我們的細胞中,DNA 中編碼的遺傳信息被轉移到信使 RNA (mRNA),後者被用作蛋白質生產的模板。 20 世紀 80 年代,引入了無需細胞培養即可產生 mRNA 的有效方法,稱為體外轉錄。 這一決定性的一步加速了分子生物學在多個領域應用的發展。 將 mRNA 技術用於疫苗和治療目的的想法也開始興起,但前方仍存在障礙。 體外轉錄的 mRNA 被認為不穩定且難以傳遞,需要開發複雜的載體脂質系統來封裝 mRNA。 此外,體外產生的 mRNA 會引起炎症反應。 因此,開發用於臨床目的的 mRNA 技術的熱情最初是有限的。
這些障礙並沒有讓匈牙利生物化學家 Katalin Karikó 灰心,她致力於開發利用 mRNA 進行治療的方法。 20 世紀 90 年代初,當她在賓夕法尼亞大學擔任助理教授時,儘管在說服研究資助者相信她的項目的重要性方面遇到了困難,但她仍然堅持實現 mRNA 作為一種治療方法的願景。 卡里科大學的一位新同事是免疫學家德魯·韋斯曼。 他對樹突狀細胞感興趣,樹突狀細胞在免疫監視和激活疫苗誘導的免疫反應中具有重要功能。 在新想法的推動下,兩者很快開始了富有成效的合作,重點研究不同 RNA 類型如何與免疫系統相互作用。
突破
Karikó 和 Weissman 注意到樹突狀細胞將體外轉錄的 mRNA 識別為外來物質,從而導致其激活並釋放炎症信號分子。 他們想知道為什麼體外轉錄的 mRNA 被認為是外來的,而來自哺乳動物細胞的 mRNA 卻沒有引起相同的反應。 Karikó 和 Weissman 意識到一些關鍵特性必須區分不同類型的 mRNA。
RNA包含四個鹼基,縮寫為A、U、G和C,對應於DNA中的A、T、G和C,即遺傳密碼的字母。 Karikó 和 Weissman 知道,哺乳動物細胞 RNA 中的鹼基經常被化學修飾,而體外轉錄的 mRNA 則不然。 他們想知道體外轉錄的 RNA 中鹼基改變的缺失是否可以解釋這種不想要的炎症反應。 為了研究這一點,他們產生了不同的 mRNA 變體,每種變體的鹼基都有獨特的化學變化,並將其傳遞給樹突狀細胞。 結果令人震驚:當 mRNA 中包含鹼基修飾時,炎症反應幾乎被消除。 這是我們對細胞如何識別和響應不同形式 mRNA 的理解的範式改變。 Karikó 和 Weissman 立即意識到,他們的發現對於使用 mRNA 進行治療具有深遠的意義。 這些開創性的結果發表於 2005 年,即 COVID-19 大流行前十五年。
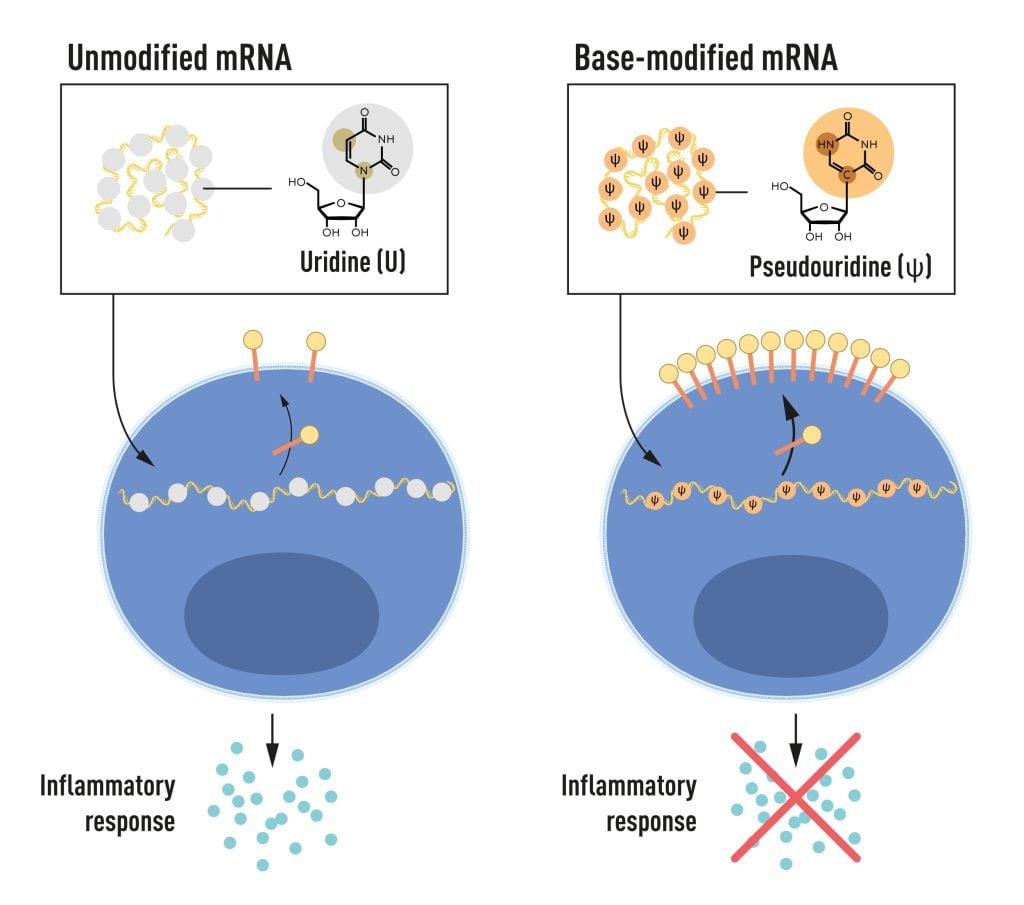
圖 2. mRNA 包含四種不同的鹼基,縮寫為 A、U、G 和 C。諾貝爾獎獲得者發現,鹼基修飾的 mRNA 可用於阻斷炎症反應的激活(信號分子的分泌),並在 mRNA 遞送至細胞。 © 諾貝爾生理學或醫學委員會。 馬蒂亞斯·卡倫
在 2008 年和 2010 年發表的進一步研究中,Karikó 和 Weissman 表明,與未修飾的 mRNA 相比,鹼基修飾生成的 mRNA 的遞送顯著增加了蛋白質產量。 這種效應是由於調節蛋白質產生的酶的活性降低所致。 通過發現鹼基修飾既能減少炎症反應又能增加蛋白質產量,Karikó 和 Weissman 消除了 mRNA 臨床應用道路上的關鍵障礙。
mRNA 疫苗發揮了其潛力
人們對 mRNA 技術的興趣開始升溫,2010 年,多家公司開始致力於開發該方法。 研髮針對寨卡病毒和中東呼吸綜合征冠狀病毒的疫苗; 後者與SARS-CoV-2密切相關。 COVID-19 大流行爆發后,兩種編碼 SARS-CoV-2 表面蛋白的鹼基修飾 mRNA 疫苗以創紀錄的速度開發出來。 據報道,保護效果約為 95%,這兩種疫苗早在 2020 年 12 月就獲得了批准。
mRNA 疫苗的開發具有令人印象深刻的靈活性和速度,為使用新平台開發針對其他傳染病的疫苗鋪平了道路。 未來,該技術還可用於輸送治療性蛋白質並治療某些癌症類型。
基於不同方法的其他幾種針對 SARS-CoV-2 的疫苗也迅速推出,全球總共已接種超過 130 億劑 COVID-19 疫苗。 這些疫苗挽救了數百萬人的生命,並預防了更多人的嚴重疾病,使社會得以開放並恢復正常狀態。 通過對 mRNA 鹼基修飾重要性的基本發現,今年的諾貝爾獎獲得者在我們這個時代最大的健康危機之一期間為這一變革性發展做出了重要貢獻。
主要出版物
Karikó, K.、Buckstein, M.、Ni, H. 和 Weissman, D. Toll 樣受體對 RNA 識別的抑制:核苷修飾的影響和 RNA 的進化起源。 免疫 23, 165–175 (2005)。
Karikó, K.、Muramatsu, H.、Welsh, F.A.、Ludwig, J.、Kato, H.、Akira, S. 和 Weissman, D. 將假尿苷摻入 mRNA 中可產生優異的非免疫原性載體,具有增加的翻譯能力和生物穩定性。 摩爾瑟爾 16, 1833–1840 (2008)。
Anderson, B.R.、Muramatsu, H.、Nallagatla, S.R.、Bevilacqua, P.C.、Sansing, L.H.、Weissman, D. 和 Karikó, K. 將假尿苷摻入 mRNA 通過減少 PKR 激活來增強翻譯。 核酸研究。 38、5884-5892(2010)。
卡塔琳·卡里科 (Katalin Karikó) 1955 年出生於匈牙利索爾諾克。 她於 1982 年在塞格德大學獲得博士學位,並在塞格德的匈牙利科學院從事博士后研究直至 1985 年。隨後,她在費城坦普爾大學和貝塞斯達健康科學大學進行博士后研究。 1989 年,她被任命為賓夕法尼亞大學助理教授,並一直任職到 2013 年。之後,她成為 BioNTech RNA Pharmaceuticals 的副總裁,後來又擔任高級副總裁。 自2021年起,她一直擔任塞格德大學教授和賓夕法尼亞大學佩雷爾曼醫學院兼職教授。
德魯·韋斯曼 (Drew Weissman) 1959 年出生於美國馬薩諸塞州列剋星敦。 1987年,他在波士頓大學獲得醫學博士、博士學位。他在哈佛醫學院貝斯以色列女執事醫療中心接受臨床培訓,並在美國國立衛生研究院進行博士后研究。 1997年,韋斯曼在賓夕法尼亞大學佩雷爾曼醫學院成立了他的研究小組。 他是羅伯茨家族疫苗研究教授和賓夕法尼亞大學 RNA 創新研究所所長。
- [10/01]問月月不應 大家發心聲
- [10/02]高官冤情與誰訴?
- [10/02]美國外交官中國來信之 評點中國(42)
- [10/03]真稀奇: 松鼠也求救?
- [10/03]詩詞見松鼠, 千古壯閑心
- [10/03] 2023年10月3日菩提道次第攝頌、修心七義 (第二天)(直播中)
- [10/04]如此識鳥 事半功倍
- [10/04]2023年10月4日達賴喇嘛尊者應台灣給予四臂觀音灌頂(正在直播)
- [10/05]美國外交官中國來信之 道德標準(43)
- [10/05]猶太媒體認為猶太哲學家應該得到今年的諾貝爾文學獎
- [10/06]美國外交官中國來信之 李去袁來(44)
- [10/07]大變局與大官們的結局- 增韞路線圖
- [10/08]美國外交官中國來信之 金鑾殿上(45)
- 查看:[change?的.最新博文]
- 查看:[大家的.最新博文]
- 查看:[大家的.其它日誌]
評論 (0 個評論)
change?最受歡迎的博文
其它[其它日誌]博文更多
- sc8808:加拿大擁有世界上最昂貴的互聯網服務之一
- qwxqwsean:一個42歲徵婚的華女把我拉黑了
- qwxqwsean:我不明白我為啥找不到老婆
- heiyonga:攻讀一年制碩士學位值得嗎? 為什麼?
- qwxqwsean:一個台北婦被搶劫兩百元的故事
- successful:帶電接線,是先接火還是先接零?
- 解濱:我們離這屆人類的終結已經多近了?
- qwxqwsean:雪城在基本生理需求方面找流浪者的麻煩
- 憨憨豆:詢問:德國為什麼寧可損失經濟,也要硬剛俄羅斯?
- yunmu:阿爾茲海默病的原創發現被疑造假
- yunmu:6種可以再生身體部位的動物
- 解濱:十億中國人信息被盜賣,黑客神秘地消失了!
- 吃布丁:資本下的英國女王
- yunmu:說兩句如何杜絕炒作高考狀元
- yunmu:一個期刊從相當於Nature影響因子的20%到220%
- yunmu:為什麼以色列猶太人人均諾獎遠低於歐美猶太人
- yunmu:美國Surgeon General算是個什麼職位?
- yunmu:農藥殘留量最多或最少的蔬菜水果
- yunmu:從院士找本行工作受阻說起
- yunmu:與外星人接觸最值得擔憂的是什麼








